CALOR Y CANTIDAD DE CALOR
Calor
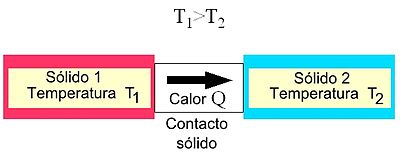
El calor se define como la transferencia de energía térmica que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.
CONDUCCIÓN
Cuando
dos partes de una materia se mantienen a temperaturas diferentes, la energía se
mantiene por colisiones moleculares de la más alta a la más baja temperatura.
CONVECCIÓN
La
convección: Se ha definido como el proceso por el que el calor es transferido
por medio del movimiento real de la masa de un medio material.
Corriente de convección: Es una corriente de liquido o de gas que absorbe energía de un lugar y lo lleva a otro, donde lo libera a una porción más fría del fluido, por eso recibe este nombre.
Corriente de convección: Es una corriente de liquido o de gas que absorbe energía de un lugar y lo lleva a otro, donde lo libera a una porción más fría del fluido, por eso recibe este nombre.
RADIACIÓN
Radiación
térmica: Se debe a ondas electromagnéticas emitida o absorbida por un sólido,
un líquido o un gas debido a su temperatura.
unidades
Caloría: (cal)
Es la cantidad de calor necesaria para elevar la temperatura de un gramo de
agua en un grado Celsius.
Kilogramo: (Kcal) Cantidad de calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius (1 Kcal=1000 cal).
Unidad Térmica Británica:(Btu) Es la cantidad de calor necesaria para elevar la temperatura de una libra patrón (Ib) de agua Fahrenheit.
Kilogramo: (Kcal) Cantidad de calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius (1 Kcal=1000 cal).
Unidad Térmica Británica:(Btu) Es la cantidad de calor necesaria para elevar la temperatura de una libra patrón (Ib) de agua Fahrenheit.
Los resultados aceptados son:
1 Cal = 4.186 J
1 Kcal¨= 4186 J
1 Btu = 778 ft-Ib
Cantidad de calor
´Cuando una sustancia se está fundiendo o evaporándose
está absorbiendo cierta cantidad de calor llamada calor
latente de fusión o calor latente de evaporación, según el caso. El calor
latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se
manifieste un incremento en la temperatura, ya que mientras
dure la fundición o la evaporación de la sustancia no se registrará variación
de la misma.
´En tanto el calor sensible es aquel que
suministrado a una sustancia eleva su temperatura.
´La experiencia ha demostrado que la cantidad de
calor tomada (o cedida) por un cuerpo es directamente proporcional a su
masa y al aumento (o disminución) de temperatura que experimenta.
´La expresión matemática de esta relación es la
ecuación calorimétrica:
Q = m· Ce· (Tf-Ti)
´Nota: La temperatura inicial (Ti) se
anota también como T0 o
como t0.
´Si Ti > Tf el cuerpo
cede calor Q < 0
´Si Ti < Tf el cuerpo
recibe calor Q > 0
calor especifico
´Se define calor específico (Ce) como la
cantidad de calor que hay que proporcionar a un gramo de sustancia para que
eleve su temperatura en un grado centígrado. En el caso particular del
agua Ce vale 1 cal/gº C ó 4,186J.
Ce=Q /M (Tf-Ti)
El calor específico de una sustancia equivale, por tanto, a una cantidad de
calor por unidad de masa y de temperatura; o en otros términos, es el calor que
debe suministrarse a la unidad de masa de una sustancia dada para elevar su
temperatura un grado.
Calor de
fusión de cada sustancia
´El calor de
fusión es una propiedad característica de cada sustancia, pues según el
material de que esté hecho el sólido requerirá cierta cantidad de calor para
fundirse. Por definición: el calor latente de fusión de una sustancia es la
cantidad de calor que requiera ésta para cambiar 1 gramo de sólido a 1 gramo de
líquido sin variar su temperatura.
´Los cálculos pertinentes se realizan utilizando las
fórmulas:
yf= Q/M Q=M.yf
´Donde λf =
calor latente de fusión en cal/gramo.
Q =
calor suministrado en calorías.
m =
masa de la sustancia en gramos.
En
el cuadro siguiente se dan algunos valores del calor latente de fusión para
diferentes sustancias.
Sustancia
λf en
cal/gr.
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Calor
especifico

No hay comentarios.:
Publicar un comentario